Доктор Хаус в каждом втором случае прописывал антибиотики широкого спектра. И они действительно спасли тысячи людей, причем не только в сериале. Однако за несколько десятилетий бактерии хорошо приспособились к этим препаратам
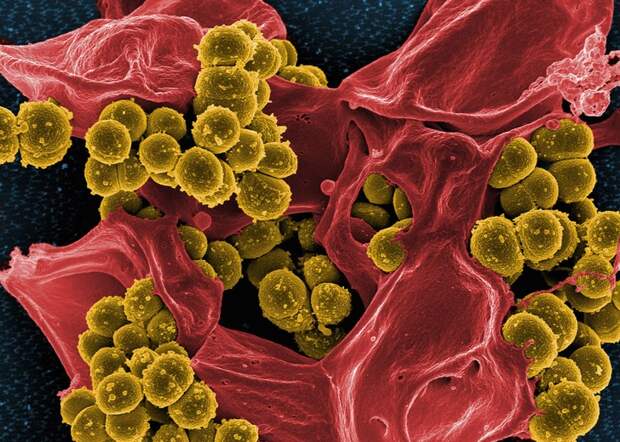
Клетки золотистого стафилококка, устойчивого к большой группе антибиотиков, на мертвом нейтрофиле — иммунной клетке человека
Фото
Image Source / Legion-Media
Мир вокруг меняется стремительно, но незаметно. Где-то в лабораториях сегодня свергают привычные истины и открывают новые, удивительные.
Открытие антибиотиков — одно из важнейших событий в медицине, оно намного увеличило среднюю продолжительность жизни людей. Но использование этих веществ неизбежно приводит к тому, что бактерии мутируют и становятся устойчивыми к имеющимся антибиотикам. Раньше это происходило медленнее, так как масштабы применения антибиотиков были намного скромнее. Возбудители инфекций реже «знакомились» с ними, и меньшее число бактерий имело шанс стать устойчивыми. Чем активнее используются антибактериальные препараты, тем серьезнее масштабы резистентности. Это вечное соревнование по типу «хищник — жертва», и к каждому новому препарату рано или поздно сформируется устойчивость.
Первый антибиотик, пенициллин, точнее бензилпенициллин, использовался в ничтожных дозах, потому что он был суперактивен. Но довольно скоро дозы выросли в миллионы (!) раз. Мутации в геноме бактерий, которые позволяют им защищаться от действия антибиотиков, распространяются в микробной популяции и приводят к развитию массовой резистентности. Постепенно пул таких мутаций расширяется и все большее количество препаратов, которые еще недавно работали, оказываются бесполезными.

Монолог.
Александр Фирсов
Профессор, член-корреспондент РАН, директор НИИ по изысканию новых антибиотиков имени Г. Ф. Гаузе РАМН
При этом новых препаратов, способных заменить антибиотики, к которым развилась массовая устойчивость, очень мало: в 1990-е годы скорость их создания была в разы больше. Причины сугубо экономические: по сравнению с лекарствами, которые пациент принимает всю жизнь, например кардиопрепаратами или инсулином, антибиотики приносят компаниям гораздо меньше денег. Цены на недавно выпущенные в продажу антибиотики весьма высоки, но это не спасает: затраты на создание оригинального препарата измеряются миллиардами долларов. Поэтому многие крупнейшие фармкомпании фактически свернули работы в области антибиотиков.
В какой-то мере это стимулировало исследования по поиску способов «управления» резистентностью, прежде всего — по установлению взаимосвязей между развитием резистентности и концентрацией антибиотиков. В клинике из-за огромного числа факторов, которые влияют на результат антибиотикотерапии, выявить такие взаимосвязи, как правило, не удается.
Помощь пришла с неожиданной стороны. В конце 1980-х были созданы так называемые динамические системы. Они выглядят как нагромождения колб, насосов и шлангов и позволяют in vitro воссоздать изменения концентрации антибиотика в организме при реальных схемах введения, которые используют врачи, и оценить гибель бактерий. В 2003 году была опубликована наша статья, в которой мы впервые описали вид зависимости между увеличением числа резистентных бактерий и режимом введения антибиотиков, смоделированном при помощи динамических систем. Оказалось, что эта зависимость имеет форму колокола. При очень низких и очень высоких концентрациях антибиотика резистентность не развивается. А вот при средних количество устойчивых к препарату бактерий возрастает на несколько порядков. Столь необычную форму зависимости удалось объяснить выдвинутой в начале 2000-х годов гипотезой «окна резистентности».
Теперь ученые могут отсечь препараты, у которых нет шансов в реальной ситуации бороться с резистентными мутантами. Оказалось, что очень многие из популярных антибиотиков при существующих схемах их применения попадают точнехонько в окно резистентности. С этим можно бороться, если давать пациенту этот препарат с еще одним антибиотиком, который «бьет» по другой мишени. Иногда такая схема позволяет сильно снизить дозу главного вещества, а значит, улучшить переносимость.
Но рано или поздно бактерии приспособятся и к двум препаратам. Прибавить к паре антибиотиков еще один — не вариант. Человеческий организм очень сложен и прогнозировать, как будут взаимодействовать между собой три или больше препаратов, невозможно. Быстро синтезировать новое вещество тоже не выйдет — процесс создания лекарства занимает годы. Впрочем, «фактор пыльного мешка» никто не отменял, и если ситуация с дефицитом новых антибиотиков станет угрожающей, то работа пойдет.
Свежие комментарии