В апреле китайские учёные из Университета Сунь Ятсена рассказали о том, что смогли отредактировать геном человека. Это открытие заставило многих исследователей и представителей научного сообщества заговорить о пользе и вреде генной инженерии, которая уже прямо сейчас меняет облик окружающего мира: от еды до насекомых-вредителей — и это только начало. О том, какую опасность может нести будущее «редактирование» людей, пишут большие фичеры издания типа Wired, этой темой интересуются не меньше чем космическими исследованиями. Apparat собрал главное о последних достижениях генной инженерии, которые могут кардинально поменять то, как мы смотрим на жизнь во всех её проявлениях.
Действительно большие муравьи
В марте ученые из университета МакГилла в Канаде научились изменять размер муравьев-древоточцев вида Camponotus floridanus.

Вот так постепенно менялся размер тех самых муравьёв
Конечно, изменения размеров муравьёв одного вида, на первый взгляд, не слишком похожи на «кардинальные изменения в том, как мы смотрим на жизнь во всех её проявлениях». Но, тем не менее, это было важное открытие. Цель у исследователей была следующая — подтвердить влияние внешней среды на развитие организмов. От неё — а не только от ДНК — зависят рост, цвет кожи, предрасположенность к полноте или её отсутствие, уровень интеллекта, склонность к развитию некоторых заболеваний и многое другое. Ген определяет наличие того или иного свойства, а внешняя среда (или «эпигенетические факторы») — то, как сильно оно проявляется. Полученная информация позволит учёным в будущем создавать организмы с нужными свойствами.
Например, коров с большей мышечной массой и сильным иммунитетом.В апреле группа ученых под руководством Саймона Тёрнера научилась манипулировать ростом и скоростью размножения деревьев. Генетики отредактировали гены, отвечающие за скорость деления клеток тополей, и в результате растения стали в два раза выше, шире, а в их кроне заметно прибавилось листьев.

Слева - тополя, которые получила в результате своих опытов группа Тёрнера
В контексте растущего спроса на биотопливо, это значительное открытие. Помимо использования в виде сырья для биотоплива, трансгенные тополя можно рассаживать вместо обычных, ведь они растут быстрее, из-за более густой кроны поглощают больше углекислого газа и вырабатывают больше кислорода.
Эти два случая — далеко не единственные примеры того, как генетическая инженерия аккуратно и незаметно меняет нашу жизнь. Исследований, подобных этим, огромное количество — и это если учитывать только те, что ведутся в открытом режиме, а не в секретных корпоративных или государственных лабораториях.
Как учёные открыли возможность редактировать гены?
В 1987 году появилась первая публикация о CRISPR — неизвестном ранее сегменте ДНК бактерий, которая сперва осталась совершенно незамеченной. Учёные, исследовавшие ДНК древних бактерий Аркея, потомков первых таких организмов на Земле, среди обычных частей генома (A, T, G, C) обнаружили повторяющиеся сегменты, которые были одинаковыми, с какого конца на них ни посмотри — палиндромы, проще говоря. Исследователи не знали зачем эти сегменты нужны, однако даже сама по себе находка была странной. Они и назвали её CRISPR — это аббревиатура от английского clustered regularly interspaced short palindromic repeats, что переводится как «Короткие палиндромные повторы, регулярно расположенные группами».
Восемнадцать лет спустя микробиолог Родольф Баранго, работавший на датскую пищевую компанию Danisco, заметил те же самые палиндромы в бактерии Streptococcus thermophilus, которая отвечает за окисление молока и используется для приготовления йогуртов и сыров. Бактерии, как и любые другие существа, подвергаются атакам вирусов, а CRISPR помогали им (бактериям) бороться с вредным воздействием. Он тут выступал в роли своего рода иммунной памяти. Баранго с коллегами решил синтезировать больше Streptococcus thermophilus с CRISPR, поскольку выживаемость этих бактерий была гораздо выше, а значит, компания экономила на сырье для своей продукции.
Ученые продолжили изучать CRISPR и вскоре наткнулись на еще одну странность — палиндромы не отвечали за синтез протеинов, хотя гены, в основном, занимаются именно этим. Тогда возникла новая гипотеза. Почти все современные животные и растения защищаются от вирусов с помощью РНК — так, может быть, CRISPR это такая изначальная имунная система?
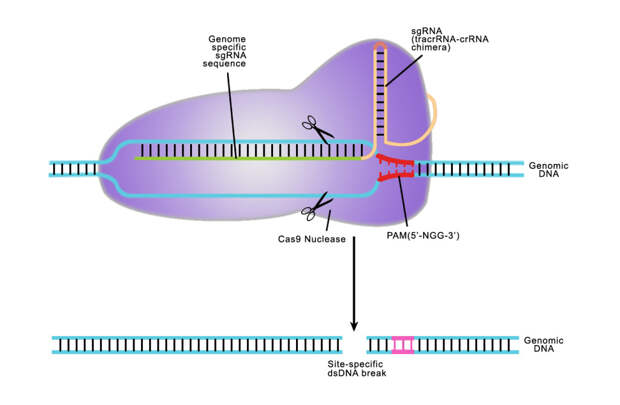
Затем в игру вступили два ведущих мировых биолога — Дженнифер Даудна и Эммануэль Шарпентье. Они встретились в 2011 году на собрании Американского общества микробиологов (American Society for Microbiology), которое проходило в Сан-Хуане, что в Пуэрто-Рико. Там, прогуливаясь по одной из дорожек, Шарпентье рассказала коллеге о том, что один из связанных с CRISPR протеинов под названием Csn1 (затем он был переименован в Cas9) имеет прямо-таки экстраординарные характеристики. Оказалось, что он способен находить определенные отрезки ДНК вирусов и делить их на части, словно микроскопическим швейцарским ножом.
Команды Шарпентье и Даудна стали работать вместе и скоро проследили весь механизм работы комплекса CRISPR-Cas9. CRISPR вырабатывает два сегмента РНК и один протеин Cas9. РНК реагирует на ДНК вируса и наводит на него Cas9, как такой своеобразный «клеточный GPS». Прибыв на место, протеин творит невероятное — он меняет форму, хватается за участок ДНК и уничтожает его точными ударами «молекулярного скальпеля». (Более подробно о том, как это работает можно прочитать здесь)
Этого учёным было мало Мартин Дзинек, постдокторант в команде Даудна, собрал два сегмента РНК в один, который смог запрограммировать. С помощью этой указующей РНК он получил возможность направлять Cas9 на абсолютно любой участок генетического кода — не только вирусный. В руках ученых оказался простой и дешевый инструмент для редактирования ДНК. По меркам генетики им так легко овладеть, что пользоваться CRISPR-Cas9 может любой аспирант в соответствующей отрасли науки. 28 июня 2012 года команда Даудна опубликовала свои результаты в журнале Science. Открытие всколыхнуло научный мир.
Как работа с ДНК превратилась в доходный бизнес?
Впрочем, исследование Даудна нельзя было назвать всеобъемлющим. Главным его недостатком было то, что команда проводила все операции над ДНК в тестовых пробирках, а не на живых клетках. Последними занялся Фэн Чжан, молекулярный биолог из Института Броуда в MIT и Гарварда. Незадолго то того, как Даудна опубликовала свою работу, Чжан запросил федеральный грант на изучение CRISPR-Cas9 как инструмента для редактирования генома. Узнав о публикации, он продолжил работать с удвоенной скоростью, поскольку знал, что теперь за новый многообещающий способ работы с ДНК схватятся все.
В январе 2013 года в том же журнале Science команда Чжанга опубликовала результаты «редактирования» человеческих и мышиных клеток. Вскоре об этом же сообщила команда Даудна, но Чжан поспешил отметить, что его способ быстрее и лучше (что, в принципе, соответствовало истине). Между двумя группами учёных началась патентная война.
Несмотря на то, что Даудна почти сразу же отправила документы, чтобы получить патент, Чжан оказался быстрее. То-ли у него был адвокат получше, то-ли обнаружились какие-то связи, но так или иначе, Чжан, Институт Броуда и MIT получили патент на использование CRISPR-Cas9 в качестве метода для редактирования генома. Зачем они так торопились? Всё просто. Теперь любая компания, которая хочет работать с бактериями, используя при этом дешевый и простой метод CRISPR-Cas9, вынуждена выплачивать Чжану, Институту и MIT роялти.
Как в Китае смогли отредактировать человеческий геном, и почему это вызвало серьёзную дискуссию?
Итак, у человечества в руках оказался инструмент для редактирования генетического кода, который от предыдущих методов отличается так же, как хирургический скальпель от ручной пилы. Нельзя сказать, что он доведён до совершенства, но улучшение CRISPR-Cas9 идет невероятными темпами. Всего за три года, прошедших с публикаций Даудна, ученые нашли огромное поле для применения CRISPR, но самые великие достижения, разумеется, впереди.
Камнем преткновения стали эксперименты с живыми человеческими клетками. Об их опасности и противоречивости ученые говорят уже давно. Но до определенного момента те, кто экспериментировал с CRISPR-Cas9 говорили об этом вопросе довольно вяло. Пока в апреле этого года китайские учёные впервые не отредактировали геном человеческого эмбриона.
Цзюньцзю Хуан и его коллеги из университета Сунь Ятсена в китайском Гуанчжоупопытались изменить в нежизнеспособных человеческих эмбрионах (то есть в тех, что всё равно умерли бы) ген, отвечающий за развитие β-талассемии — генетического заболевания, которое приводит к ранней смерти. Из 86 эмбрионов только в 28 CRISPR-Cas9 успешно связался с ДНК, а замещение генетического материала наблюдалось в еще меньшем количестве подопытных эмбрионов. Несмотря на неудачу, исследование продвинуло далеко вперед как науку, так и дискуссию о моральной стороне генетической модификации человека. Публикация об исследовании появилась в журнале Protein & Cell — крупные западные издания не стали её размещать. Однако открытие китайцев в итоге заставило западных учёных вновь начать обсуждение этической стороны дела.
Сомнения выразила та же Даудна, заявившая, что нужно «удостовериться в том, что проводимые исследования исключают любой вред». Незадолго до открытия китайских учёных с заявлением об опасности экспериментов выступило Международное общество по исследованиям стволовых клеток (ISSCR). К дискуссии подключились и другие представители научного сообщества. «Есть опасение, что инженерия зародышевой линии приведёт к попыткам создания сверхлюдей и младенцев под заказ для тех, кто может себе это позволить, — пишет главный редактор MIT Technology Review Антонио Регаладо — Почему бы тогда не создать очень умную группу людей, которые могли бы стать будущими лидерами и учёными?»
Почему редактирование геномов может быть опасным для человечества?
CRISPR-Cas9 сулит человечеству многое, и в этом смысле его можно сравнить с ядерным синтезом, который привёл к появлению атомных электростанций и ядерных боеголовок. Используя этот метод редактирования ДНК, учёные уже справились с мутациями, вызывающими слепоту, научились останавливать размножение раковых клеток, и сделали клетки некоторых организмов невосприимчивыми к СПИДу. Агрономы вырастили пшеницу, которой не страшны грибковые болезни вроде настоящей мучнистой росы, а благодаря её урожайности и устойчивости к изменениям климата, проблема того, как прокормить 9 миллиардов человек на постоянно нагревающейся планете может, наконец, уйти в прошлое. С помощью CRISPR биоинженеры «сконструировали» дрожжи, которые поглощают растительный материал и вырабатывают этанол — сложно даже представить как это может повлиять на нефтяной рынок.
В более длительной перспективе метод CRISPR-Cas9 может привести человечество к совершенно новому витку развития. Ведь если учёные отринут боязнь перед исследованиями человеческих геномов и продолжат эксперименты на эмбрионах, то вскоре мы можем получить людей, невосприимчивых к заболеваниям, стареющих медленнее, а живущих дольше. Исследования на этот счет уже ведутся. Родители смогут задавать черты ребенка еще до того, как он родится. Помимо этого, люди получат возможность изменять всю окружающую их природу: растения и животные станут такими, какими нужно — ни о каком голоде тогда речь даже не будет идти. Человечеству в руки попал невероятный по силе инструмент — и настолько же опасный.
В Гарвардской школе здравоохранения (Harvard School of Public Health) ученый Кевин Эсвельт работает над тем, чтобы с помощью генной инженерии полностью справиться с малярией. В лаборатории он с коллегами редактирует геном африканских комаров Anopheles gambiae, чтобы они не могли переносить заболевание. Но речь идет не о единичных комарах — с помощью CRISPR-Cas9 можно изменить их всех. Пока что этот проект не доведен до конца, но уже сейчас очевидно то, насколько он может быть опасен. Неизвестно как генетически измененные комары повлияют на свой ареал обитания — ведь они входят в пищевые цепи. Никто не знает, что станет с летучей мышью или иным насекомоядным хищником, который съест трансгенного комара.
Учёным потребуются годы, чтобы изучить все возможные последствия их опыта. Эсвельт опубликовал статью, где, помимо описания ранних результатов его исследований, содержится подробный перечень мер предосторожности. Например, эксперименты такого рода должны проводиться в местах, неродных для исследуемых организмов, а у внесенных в геном изменений должен быть «выключатель».
Но биологи из Сан-Диего работу Эсвельта не читали. Они проводили похожие эксперименты на фруктовых мухах без вышеупомянутых предосторожностей и, по словам Джорджа Чёрча из Кембриджа, «зашли слишком далеко».
И ведь это только комары с относительно незначительными изменениями в их геноме, по сравнению с теми же искусственно выращенными из слоновьих клеток мамонтами. Совершенные люди, неуязвимые для болезней и живущие по двести лет — это, конечно, очень красивая идея, но до неё еще очень далеко. А пока что человечеству в лице учёных придется решить как координировать или централизовать исследования с использованием CRISPR-Cas9 — иначе может оказаться, что люди действительно открыли ещё один Ящик Пандоры.
Свежие комментарии